در ترمودینامیک و مهندسی شیمی، تعادل بخار- مایع (VLE) توزیع یک گونه شیمیایی بین فاز بخار و فاز مایع را توصیف میکند. در برخی موارد دیدم که بعضی ها علت وجود آب بالای زمین (بحر مکفوف) رو به این مورد ربط میدن لذا لازم دونستم توضیحات لازم در مورد تعادل مایع – بخار و قانون چارلز رو بنویسم.
تعادل مایع–بخار(به انگلیسی: Vapor–liquid equilibrium) در علم ترمودینامیک به حالت گفته میشود که دو فاز مایع و بخار در تعادل باشند یعنی مقدار بخار میعان شده با مقدار مایع در حال جوش با هم برابر باشد.در این شرایط جرم بخار و مایع تقریباً ثابت باقی می ماند. تعادلمایع –بخار در بررسی فرایندهایی چون تبخیر و تقطیر کاربرد وسیعی دارد.
غلظت بخار در تماس با مایع خود، به ویژه در حالت تعادل، اغلب بر حسب فشار بخار بیان می شود، که در صورت وجود هر گاز دیگری با فشار بخار، فشار جزئی (بخشی از فشار کل گاز) خواهد بود. بخار فشار بخار تعادلی یک مایع به طور کلی به شدت به دما بستگی دارد. در تعادل بخار-مایع، مایعی با اجزای مجزا در غلظتهای معین، بخار تعادلی خواهد داشت که در آن غلظت یا فشار جزئی اجزای بخار بسته به تمام غلظت اجزای مایع و دما، مقادیر معینی دارد. عکس این قضیه نیز صادق است: اگر بخاری با اجزایی در غلظتهای معین یا فشار جزئی در تعادل بخار-مایع با مایع خود باشد، غلظت اجزا در مایع بسته به غلظت بخار و دما تعیین میشود. غلظت تعادلی هر جزء در فاز مایع اغلب با غلظت آن (یا فشار بخار) در فاز بخار متفاوت است، اما یک رابطه وجود دارد. داده های غلظت VLE را می توان به صورت تجربی تعیین کرد و با کمک نظریه هایی مانند قانون رائول، قانون دالتون و قانون هنری تقریبی کرد.
- قانون دالتون، در شیمی و فیزیک، قانونی است که فشار کل یک گاز را با معادلهای به مجموع فشار هر جز گاز مرتبط میکند این قانون در مورد گازهای کامل همخوانی دارد این قانون توسط جان دالتون و در سال ۱۸۰۱ به وجود آمد.
- قانون هنری که به افتخار ویلیام هنری نامگذاری شدهاست به مقداری از یک گاز که در حجم معینی از یک مایع در دمای ثابت حل میشود و با فشار گاز متناسب است اطلاق میگردد.در شیمی، قانون هنری قانون گاز است که بیان میکند که مقدار گاز حل شده با فشار جزئی آن در فاز گاز متناسب است.عامل تناسب ثابت قانون هنری نامیده میشود. این قانون توسط شیمیدان انگلیسی ویلیام هنری،که در اوایل قرن نوزدهم مورد مطالعه قرار گرفت، فرموله شد. او در نشریه خود در مورد مقدار گازهای جذب شده توسط آب، نتایج آزمایش هایش را شرح داد: شرط پیروی از این قانون آن است که میان گاز و مایع واکنش شیمیایی رخ ندهد.
- قانون رائول که به افتخار فرانسوا ماری رائول نامگذاری شده است بیان میکند: فشار یک بخار وابسته است به ترکیبات شیمیایی آن و تجزیه مولی ذراتش فشار یک بخار در حالت تعادل برابر است با:
![]()
چنین اطلاعات تعادل بخار-مایع در طراحی ستونهایی برای تقطیر، بهویژه تقطیر کسری، که تخصص خاص مهندسین شیمی است، مفید است. تقطیر فرآیندی است که برای جداسازی یا جداسازی جزئی اجزای یک مخلوط از طریق جوشاندن (تبخیر) و سپس تراکم استفاده می شود. تقطیر از تفاوت در غلظت اجزاء در فاز مایع و بخار بهره می برد.
در مخلوط های حاوی دو یا چند جزء، غلظت هر جزء اغلب به صورت کسرهای مول بیان می شود. کسر مولی یک جزء معین از یک مخلوط در یک فاز خاص (اعم از فاز بخار یا فاز مایع) تعداد مول های آن جزء در آن فاز تقسیم بر تعداد کل مول های تمام اجزای آن فاز است.
مخلوط های دوتایی آنهایی هستند که دارای دو جزء هستند. مخلوط های سه جزئی را مخلوط های سه تایی می گویند. ممکن است داده های VLE برای مخلوط هایی با اجزای بیشتر وجود داشته باشد، اما نمایش چنین داده هایی اغلب به صورت گرافیکی دشوار است. داده های VLE تابعی از فشار کل است، مانند 1 atm یا در فشاری که فرآیند در آن انجام می شود.
وقتی به دمایی رسید که مجموع فشارهای بخار تعادلی اجزای مایع برابر با فشار کل سیستم شد (در غیر این صورت کوچکتر است)، آنگاه حباب های بخار تولید شده از مایع شروع به جابجایی گازی می کنند که در حال حفظ است. فشار کلی، و گفته می شود که مخلوط به جوش می آید. این دما را نقطه جوش مخلوط مایع در فشار معین می گویند. (فرض می شود که فشار کل با تنظیم حجم کل سیستم برای تطبیق با تغییرات حجمی خاص که همراه با جوشش است، ثابت نگه داشته می شود.) نقطه جوش در فشار کلی 1 اتمسفر، نقطه جوش معمولی مخلوط مایع نامیده می شود. .
قانون چارلز
در فيزيک، قانون چارلز اصلي است که، با تأثيرات گرما بر انبساط گازها سروکار دارد، قانون چارلز مي گويد: اگر فشار گاز ثابت باشد، با افزايش دما، حجم گاز افزايش خواهد يافت. بنابراين اگر دما بالا رود، گاز حجم بيشتري را اشغال مي کند. اگر دما کاهش يابد، گاز حجم کمتري را اشغال مي کند. اين اصل اولين بار در سال 1787 توسط فيزيک دان فرانسوي، ژاک الکساندر سزار چارلز به صورت فرمول درآمد.
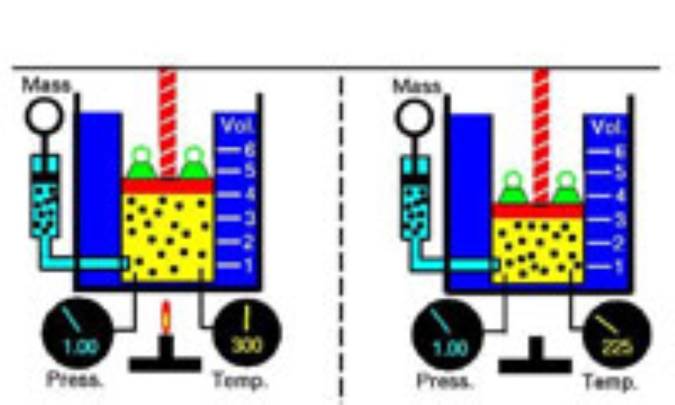
قانون چارلز به اين شکل به صورت فرمولي بيان مي شود:
هر کجا V1 برابر با حجم اصلي باشد، V2 برابر حجم جديد خواهد بود و T1 برابر دماي اصلي و T2 دماي جديد خواهد بود.
در استفاده از قانون چارلز دماها بايد به مقياس کلوين، که در آن دماي صفر برابر با صفر مطلق(دماي منهاي273/15 درجه ي سانتي گراد)، است، تبديل شود.